Axolotl Chytridpilz
Axolotl Chytridpilz
Chytridpilz Axolotl
Batrachochytrium dendrobatidis (Bd) oder Chytridpilz beim Axolotl
Autoren: Christina Liebsch und Dr. Frank Mutschmann und Malek Hallinger (2020)
Was ist eine Chytridmykose?
Chytridiomykose ist eine weltweit vorkommende Amphibienseuche (emerging disease) die von einem Pilz („Chyridpilz“) hervorgerufen wird. Das Krankheitsbild der „Chytridmykose“ wird durch die Infektion mit Batrachochytrium dendrobatidis (Bd), einem Töpfchenpilz (Chytridiomycota), welcher zur Ordnung Rhizophydiales gehört. Nach einer derzeit weit verbreiteten Theorie wird vermutet, dass der Chytridpilz ursprünglich aus Afrika stammt. Er besiedelt die Haut von afrikanischen Krallenfröschen (Xenopus sp.).1998 wurde der Pilz erstmals auch bei Terrarientieren in Europa nachgewiesen (Mutschmann 2000), nachdem er vorher schon in Nord-, Mittel- und Südamerika sowie Australien auftrat.
BD ist ein diploider Chytridiomyzet, der auf der Haut von Amphibien mit zwei Lebensstadien auftritt: ein Zoosporangium, in dem sich Zoosporen entwickeln, und die Zoosporen, die als infektiöses Stadium der Verbreitung dienen (Tobler et al 2010).
Mittlerweile gibt es mehrere genetisch unterschiedliche Stämme, wobei der afrikanische Stamm gefährlicher für die erkrankten Amphibien als die europäischen Stämme zu sein scheint. Die afrikanischen Stämme scheinen eine größere Letalität (Sterblichkeit) zu verursachen als die europäischen Stämme (Fisher et al 2009). Es ist mittlerweile bekannt, dass ein sehr großer Teil der europäischen Amphibien mit diesem Pilz infiziert sind. Es wird angenommen, dass BD vielen Amphibien mit intakten Abwehrkräften und guten Umweltbedingungen primär nichts anhaben kann. Erst Stress, Klimaänderungen oder auch die Kombination mit anderen Erregern führen dann zum Ausbruch der Krankheit. Der Pilzbefall muss also nicht zwangsläufig zu einer tödlichen Erkrankung führen. In Mitteleuropa gibt es bislang keine Hinweise auf Massenverluste heimischer Amphibien aufgrund dieser Infektion. In Europa kam es bisher lediglich in Zentralspanien zu einem regionalen Massensterben von Geburtshelferkröten und Feuersalamandern.
Exogene Stressoren (Klima, Populationsdruck, Transport usw.) provozieren den Ausbruch der Krankheit.
Als infektiöses Stadium fungieren die beweglichen Zoosporen, welche entweder von Tier zu Tier über Körperkontakt übertragen werden oder über das Wasser ihren Wirt aufsuchen. Die frei schwimmenden Zoosporen sind ca. 3–5 μm lang und besitzen eine 19–20 μm lange Geißel, mit der sie sich fortbewegen (Tobler et al 2010). Chytridpilze bilden keine Hyphen (fadenförmige Zellen der Pilze) aus. Es handelt sich bei dem mehr als 3000 Arten hauptsächlich um Algen- und Pflanzenparasiten, andere Arten befallen auch Weichtiere (Mollusken), wie Schnecken oder Würmer, oder Fische. Die Erreger können sowohl mit Pflanzen und Tieren (z.B. Futtertiere wie Garnelen), als auch über nicht biotisches Material verbreitet werden.
BD selber ist allerdings an Feuchtigkeit gebunden und bei Trockenheit und UV-Einstrahlung kurzlebig (weniger als 24 h). Die Zoosporangien sind unter gewissen Umständen in der Umwelt bis zu einem viertel Jahr überlebensfähig. Da in den deutschen Trinkwasserversorgungen kaum auf Keime gefiltert wird, kann sich der Pilz theoretisch auch im Abwasser und Trinkwassersystem verbreiten. Es ist auch bekannt, dass es einen Temperatureffekt bei BD gibt. Der Erreger mag tiefere Temperaturen (leider wie unsere Amphibien auch) und ist bei Temperaturen von 4–28°C vermehrungsfähig. Dies kann je nach Stamm leicht variieren.
BD ist pH-sensibel und sein Optimum liegt bei einem pH von 6 – 7.
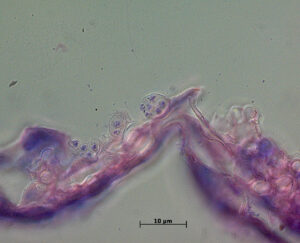
Chytridiomykose (Batrachochytrium dendrobatidis) (Fotos M. Hallinger, exomed)
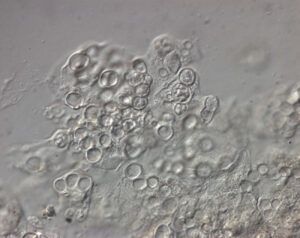
Chytridinfektion, (Fotos M. Hallinger, exomed)
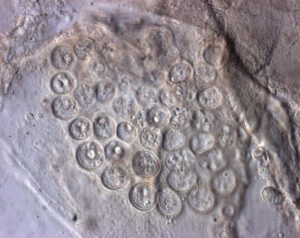
Sporangien in der Histologie (HE), Krallenfrosch (Xenopus laevis) (Fotos M. Hallinger, exomed)
Ausbreitung und Krankheitssymptome
Der Chytridpilz befällt in erster Linie verhornte Amphibienhautteile. Treffen die Zoosporen auf Amphibienhaut, dringen sie in die Keratinschicht (verhornter Teil) der Haut ein und kapseln sich dort ein, worauf die Vermehrungsphase als Zoosporangium beginnt. In den Zoosporangien bilden sich neue Zoosporen. Wenn diese reif sind, werden sie durch einen oder mehrere Ausfuhrgänge durch die Amphibienhaut hindurch an die Umwelt abgegeben. Dort können sie entweder direkt benachbarte Hautpartien oder einen neuen Wirt infizieren. Beim neotenen Axolotl kann sich der Pilz allerdings auch in die Schleimhaut setzen. Dies sind dann meist Stellen, welche einer Belastung oder Reibung ausgesetzt sind, wie die Maulspalte, Kloakenunterseite, Fußunterseite, Bauch und Schwanzunterseite. Todesfälle aufgrund einer direkten Bd-Infektion sind bei Amphibienlarven und somit auch beim neotenen Axolotl kaum zu erwarten, anders als bei Tieren während oder kurz nach der Metamorphose.
Die klinischen Anzeichen einer solchen Infektion sind relativ unspezifisch und sehr verschieden. Mit dem bloßen Auge manifeste Symptome treten nur bei massivem Befall auf. Diese äußern sich als Veränderungen der Hautfarbe, wie plötzlich schwarze oder braune Pigmentation von Weißlingen an der Kloakenunterseite oder Fußsohlen, Para- bzw. Hyperkeratosen äußern sich in Folge der Infektion als verdickte Hautschichten an den Flanken oder Bauchunterseite der Tiere. Verhaltensänderungen, Apathie, Bewegungsstörungen, Krämpfe sowie sekundäre bakterielle oder andere Pilzinfektionen sind oft Folge einer solchen Infektion.
Es wird vermutet, dass der Pilz den Wasser- und Elektrolyt-Haushalt der Amphibien beeinträchtigt. Ferner schwächt ein Chytridpilz-Befall die Abwehrkraft der Tiere so weit ab, dass weitere Erkrankungen schnell hinzukommen können (z.B. bakterielle Infektionen). Dies geschieht unter anderem auch durch eine Störung der Barrierefunktion der Haut, welche dann anderen Krankheitserregern das Eindringen in den Körper erleichtert.
Die Chytridmykose bedroht also gleichermaßen Terrarien- und Wildpopulationen. Der unkontrollierten Ausbreitung des Pilzes kann nur mit Quarantäne, Hygiene und Diagnostik begegnet werden.
Diagnostik: verstorbene Tiere
Bei spontanen Todesfällen, die nicht alle Tiere des Bestandes treffen müssen, sollte man hellhörig werden und die toten Tiere zur Sektion/Obduktion zum Labor exomed (www.exomed.de) schicken! Dabei ist darauf zu achten, dass beim Versand die Tiere ausreichend gekühlt werden. Werden die Tiere nicht ausreichend gekühlt, kann es während dem Versand zur Autolyse (Verwesung) kommen, die diagnostischen Möglichkeiten sind dann eingeschränkt. Unmittelbar nach dem Versterben sollten sie im Kühlschrank bei ca. 5 Grad Celsius gelagert werden. Bei Rückfragen am besten direkt an exomed wenden.
Eine Chytridmykose kann in histologischen Schnitten vom Sektionstier nachgewiesen werden. Hierzu werden von der Haut der verstorbenen Tiere Gewebeschnitte angefertigt, in diesem lässt sich dann mikroskopisch eine Infektion mit Bd nachweisen (Sporangien, Bilder).
Diagnostik: lebende Tiere
Einen großen Vorteil bietet bei lebenden Tieren die nicht-invasive Untersuchung des Tieres mittels Abstrich.
Dabei werden Abstriche am lebenden Tier entnommen. Geeignet sind hierfür trockene Tupfer, welche Hautzellen sehr gut aufnehmen. Getupfert wird hierfür beim Axolotl an der Maulkante vor den Zahnreihen, unter den Fußsohlen, unter dem Bauch, Kloake und an der Schwimmsaumunterseite. Die Tupfer werden hiernach zur PCR-Identifizierung eingeschickt (www.exomed.de).
Untersucht wird der Abstrich in Form einer spezifischen Realtime-PCR (RT-PCR). Hierbei werden die untersuchten Proben genetisch mit allen gängigen europäischen und afrikanischen Stämmen verglichen. Dabei können falsch positive Befunde mit eng verwandten Pilzen aufgrund struktureller Übereinstimmungen ausgeschlossen werden (Mutschmann, Erkrankungen der Amphibien 2010). Um eine genaue Auswertung der Proben zu gewährleisten muss bei der Probenentnahme und beim Transport äußerste Hygiene und Vorsicht walten. Da hierbei DNA in geringsten Spuren nachgewiesen wird, dürfen die Proben nicht kontaminiert sein. Bei unseren Krankheitssymptomen bietet es sich ebenso an, ein Amphibienhautprofil untersuchen zu lassen, bei dem sowohl ein eventueller Befall mit Chytridpilzen, als auch eine bakteriologische/mykologische Untersuchung (inklusive Resistogramm) untersucht wird.
Behandlung
Erkrankte oder infektionsgefährdete Tiere werden mit einem Antimykotikum z.B. Itraconazol als 10 minütiges Bad oder Dauerbad mit geringerer Konzentration täglich über 8–10 Tage behandelt (Johnson et al 2003). Nach eigenen Erfahrungen ist die Itrafungollösung zur Therapie einer Bd-Infektion für Axolotl mäßig geeignet, da sie bei empfindlichen/schwer erkrankten Tieren und anderen Ambystomatiden möglichweise zu einer erhöhten Mortalität auf Grund der darin enthaltenen Lösungsstoffe führen kann. Am besten geeignet sind Itrakonazolkaspeln, deren Inhaltsstoffe man in Wasser auflöst, diese müssen jedoch von dem/der behandelnden Tierarzt/Tierärztin aus der Humanmedizin ungewidmet werden.
Alternativ eignen sich Dauerbäder mit Chloramphenicol, diversen Farbstoffen oder Kurzzeitbäder mit Lamisil.
Pflanzen, Posthornschnecken sowie Garnelen können auch mit Itrafungol im Dauerbad behandelt und somit pilzfrei werden. Gerade Garnelen vertragen die Behandlung sehr gut.
Itraconazol gibt es bei einem positiven Befund bei VeterinärInnen oder auf Rezept. Frei verkäuflich ist es nicht und sollte auch nicht prophylaktisch angewendet werden.
Aquarien, Filter sowie Kühler, Einrichtung und sonstiges Zubehör müssen gründlich gereinigt und desinfiziert werden (z. B. mit Virkon S 1%). Abgelassenes Aquariumwasser darf nicht ohne Desinfektion (Hitze mit einer Kerntemperatur von mindestens 60 Grad, Desinfektion mit Benzalkoniumchlorid oder Virkon S) in die Umwelt entlassen werden.
Abgabetiere und Pflanzen
Man muss sich bewusst sein, dass der Chytridpilz auch Futtertiere wie Guppys, Kadinalfische oder auch Schnecken/Garnelen befallen kann, ohne dass die Tiere erkranken, sondern nur als Überträger dienen. Deshalb sollten nur Tiere aus einem Chytrid-freien Bestand abgegeben und aufgenommen werden.
Dasselbe gilt auch für Axolotl-Abgabetiere. Die Tiere können symptomfrei sein aber dennoch als Überträger fungieren. Deswegen sollten nur getestete Tiere abgegeben bzw. der Bestand regelmäßig auf Chytrid überprüft werden (als grobe Faustregel 1x/jährlich).
In neuen Beständen dürfen die Tiere trotz negativem Chytridbefund nicht ohne eine ausreichende Quarantäne eingeführt werden. Auffälligkeiten zeigend die Tiere meist in der Quarantänezeit, da sie durch den Umzug Stress haben und sich erst an die neuen Wasserbedingungen gewöhnen müssen.
Eine Alaun- bzw. Kaliumpermanganat-Desinfektion von Pflanzen reicht nicht aus. Daher wäre es wünschenswert, wenn man nur Pflanzen nur aus sicher chytridfreien Beständen in seine Aquarien einbringt.
Nachtrag
Axolotl sind nicht krankheitsanfälliger als andere Tiere.
Bei Kleintieren, wie z.B. Hunden und Katzen sind eine ausreichende Entwurmung und Impfungen gegen verschiedene Infektionen mittlerweile Standard und werden auch so von den HalterInnen anerkannt. Auch bei anderen Tieren, wie Amphibien, liegt eine pflichtbewusste Haltung, ein gutes Hygienemanagementsowie Quarantäne und Bestandsüberprüfung bei dem/der gewissenhaften ZüchterIn/HalterIn.
Literatur
Fisher MC, Bosch J, Yin Z, Stead DA, Walker J, Selway L, Brown AJP, Walker LA, Gow NAR, Stajich JE, Garner TWJ. (2009). Proteomic and phenotypic profiling of the amphibian pathogen Batrachochytrium dendrobatidis shows that genotype is linked to virulence. Mol Ecol. 18:415-429
Johnson M L, Berger L, Philips L, Speare R, Fungicidal effects of chemical disinfectants, UV light, desiccation and heat on the amphibian chytrid Batrachochytrium dendrobatidis, Dis Aquat Org, 2003, Vol. 57: 255–260
Mutschmann F, Erkrankungen der Amphibien, Enke Verlag 2010
Mutschmann F, Berger L, Zwart P, Gaedicke C, Chytridiomykose bei Amphibien – erstmaliger Nachweis in Europa. Berl Munch Tierarztl Wochenschr. 2000 Oct;113(10):380-3
Mutschmann F, Amphibian declining, Labor&more, 3 ,2008, S 30-32
Tobler U, Schmidt BR, Geiger C, Batrachochytrium dendrobatidis: ein Chytridpilz, der zum weltweiten Amphibiensterben beiträgt, Zurich Open Repository and Archive, 2010, S 112-117